
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
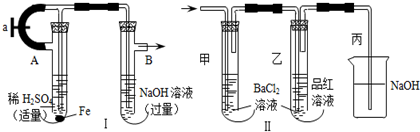
查看答案和解析>>
科目: 来源: 题型:选择题
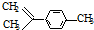 ,有关分析正确的是( )
,有关分析正确的是( )| A. | 一氯代物共有7种 | B. | 分子中所有碳原子一定在同一平面 | ||
| C. | 和 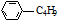 互为同分异构体 互为同分异构体 | D. | 1mol柠檬烯与H2反应最多消耗4mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀硝酸中加入过量铁粉:Fe+4H++NO${\;}_{3}^{-}$═Fe3++NO↑+2H2O | |
| B. | 向NH4HSO4溶液中逐滴滴入Ba(OH)2溶液至恰好沉淀完全2OH-+Ba2++2H++SO${\;}_{4}^{2-}$═2H2O+BaSO4↓ | |
| C. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO${\;}_{3}^{-}$═3BaSO4↓+2NO↑+H2O | |
| D. | 向Ca(ClO)2溶液中通入足量CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
查看答案和解析>>
科目: 来源: 题型:解答题
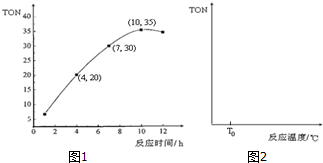
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
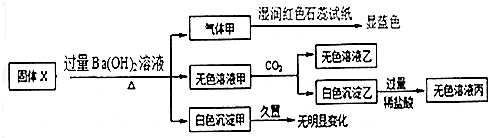
| A. | 气体甲一定是纯净物 | |
| B. | 白色沉淀乙不一定是Al(OH)3 | |
| C. | 固体X中一定存在 (NH4)2SO4、MgCl2、AlCl3 | |
| D. | 固体X中一定存在FeCl2、AlCl3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用漏斗过滤,去除盐水中的CaCO3 | B. | 用饱和食盐水洗去Cl2中少量的HCl | ||
| C. | 用CCl4萃取碘水中的碘 | D. | 用升华法除去NaCl中混有的少量碘 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com