
科目: 来源: 题型:解答题
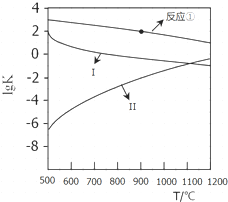 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,18gH2O中含有的原子总数为3NA | |
| B. | 在标准状况下,22.4L Cl2完全溶于水转移的电子数目的为NA | |
| C. | 1L 0.1 mol•L-1 NaHCO3溶液中含有0.1NA个HCO3- | |
| D. | 常温下,pH=7的NaCl溶液中含有的OH-数目为10-7NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| B. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| C. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L由H2和O2组成的混合气体,所含分子总数为NA | |
| B. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| C. | 常温常压下,1 mol氖气含有的原子数为NA | |
| D. | 1L1 mol.L-l FeCl3溶液中Fe3+的数目小于NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a×b×18×6.02×1023 | B. | $\frac{18b}{a}$×6.02×1023 | ||
| C. | $\frac{18a}{b}$×6.02×1023 | D. | $\frac{b}{18a}$×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com