
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 反应过程中的氧化产物均为SO3 | |
| B. | a点时消耗NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I?与I2的物质的量之比为1:1时,加入的NaIO3为1.2 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用Br2的CCl4溶液鉴别CH2=CH2和HC≡CH | |
| B. | 用AgNO3溶液鉴别KCl溶液和MgCl2溶液 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
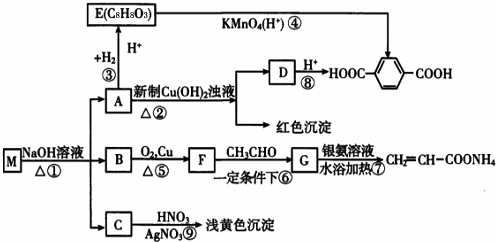
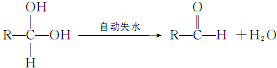
 ;E:
;E: ;G:CH2=CHCHO.
;G:CH2=CHCHO. .
. (写一种).
(写一种).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔点260.7K | B. | 具有很高的比热 | C. | 可作冷却剂 | D. | 能跟水剧烈反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
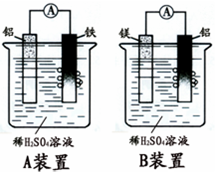 有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,
有甲.乙两位学生分别利用如图A,B装置的原电池反应检测金属的活动性顺序,查看答案和解析>>
科目: 来源: 题型:解答题
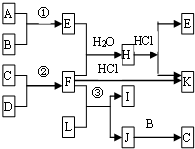 如图是部分短周期元素的单质及其化合物的转化关系图
如图是部分短周期元素的单质及其化合物的转化关系图| 溶液酸碱性 | 离子浓度大小顺序 | |
| 1 | 酸性 | |
| 2 | 中性 | |
| 3 | 碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com