
科目: 来源: 题型:选择题
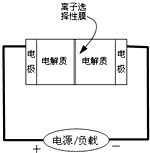 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )| A. | 充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.2mol电子 | |
| B. | 放电过程中钠离子从右到左通过离子交换膜 | |
| C. | 电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+ | |
| D. | 充电过程中钠离子从右到左通过离子交换膜 |
查看答案和解析>>
科目: 来源: 题型:选择题
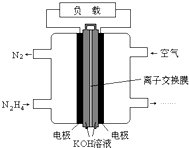 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )| A. | 电流从右侧电极经过负载后流向左侧电极 | |
| B. | 负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O | |
| C. | 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据碳酸盐与盐酸反应能放出二氧化碳气体,确定某矿石中是否含碳酸盐 | |
| B. | 根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维 | |
| C. | 根据加入氯化钡溶液的方法来检验溶液中是否含有硫酸根离子 | |
| D. | 根据氨气能使湿润的红色石蕊试纸变蓝色,可以用于铵根离子的检验 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | ||
| C. | 既无氧化性又无还原性 | D. | 既有氧化性又有还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3放出的CO2多 | B. | NaHCO3放出的CO2多 | ||
| C. | Na2CO3放出CO2的速率快 | D. | NaHCO3放出CO2的速率快 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铁跟盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸亚铁溶液中加过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 硝酸铁溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+ |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | BaCl2+K2SO4═BaSO4↓+2KCl | B. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | ||
| C. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | D. | Ba(OH)2+2KHSO4═BaSO4↓+K2SO4+2H2O |
查看答案和解析>>
科目: 来源: 题型:填空题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com