
科目: 来源: 题型:选择题
| 容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.1 | 0.15 | 0.05 | - |
| Ⅱ | 607 | 0.2 | 0.3 | - | |
| Ⅲ | 627 | 0.1 | 0.15 | - | 6×10-2 |
| A. | 该反应为吸热反应 | |
| B. | 607K时,该反应的平衡常数为0.50 | |
| C. | 容器Ⅱ达到平衡时,容器中COS的物质的量浓度为0.025 mol.L-1 | |
| D. | 容器Ⅲ达到平衡时,再充入少量氦气,平衡将向正反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | X溶液 | 固体Y | Z溶液 | 现象 |  |
| A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
| B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
| C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
| D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
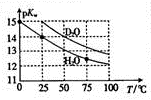 Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )
Hz0与D20的pKw (pKw=-lgKw)与温度的关系如图所示,下列有关说法正确的是( )| A. | D20的电离过程为吸热过程 | B. | 25℃时,纯D20的pH等于7 | ||
| C. | 25℃时,pH=7的液体一定是纯H20 | D. | 常温下,向Dz0中加入DCI,pKw变大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上述反应既属于氧化还原反应,又属于离子反应 | |
| B. | 生成1 mol Cl2转移电子数均为2NA | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO>HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为SiO2 | B. | 熔化时共价键断裂 | ||
| C. | 属于酸性氧化物 | D. | 1mol SiO2中含有4 mol Si-O键 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O、Na2O2都是钠的氧化物,都是碱性氧化物 | |
| B. | Na2O、Na2O2都是易溶于水(与水反应)的白色固体 | |
| C. | Na2O2在和CO2的反应中既是氧化剂又是还原剂 | |
| D. | Na2O2与水反应时,1mol Na2O2转移2 mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
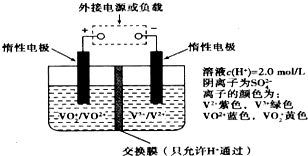 在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )| A. | 充电过程中,H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 | |
| B. | 放电过程中,右槽溶液中溶液颜色由紫色变为绿色 | |
| C. | 该电池为可逆电池,当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 | |
| D. | 充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)增加了0.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com