
科目: 来源: 题型:选择题
| A. | 5% | B. | 25% | C. | 17% | D. | 33% |
查看答案和解析>>
科目: 来源: 题型:解答题
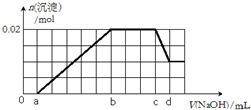 有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 150mL 1mol•L-1氯化钠溶液 | B. | 75mL 1.5mol•L-1氯化钙溶液 | ||
| C. | 150mL 3mol•L-1氯酸钾溶液 | D. | 50mL 1mol•L-1氯化镁溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 每消耗1 mol H2O2,转移的电子为1 mol | |
| D. | 该电池的正极反应为BH4-+8OH--8e-═BO2-+6H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 21.2g | B. | 21.6g | C. | 22.0g | D. | 22.4g |
查看答案和解析>>
科目: 来源: 题型:填空题
| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
查看答案和解析>>
科目: 来源: 题型:填空题
 ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)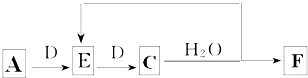
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com