
科目: 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 [Al(OH)2]++H+.
[Al(OH)2]++H+.
查看答案和解析>>
科目: 来源: 题型:解答题
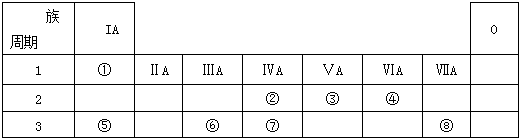
 .
.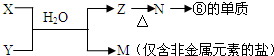
查看答案和解析>>
科目: 来源: 题型:解答题
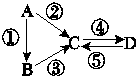 根据物质性质完成下列题型.
根据物质性质完成下列题型.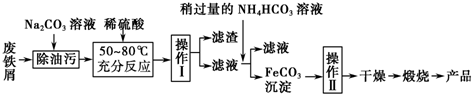
查看答案和解析>>
科目: 来源: 题型:解答题
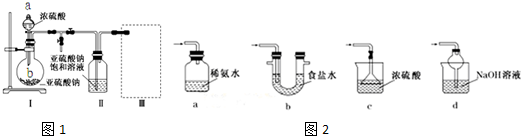
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅:2NO2(g)??N2O4(g)△H<0 (红棕色) (无色) | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe3++2NO↑+4H2O | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO${\;}_{3}^{2-}$+H2O?HCO${\;}_{3}^{-}$+OH- |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时,电池的负极反应为LiC6-e-═Li++C6 | |
| B. | 充电时,电池的正极反应为CoO2+Li++e-═LiCoO2 | |
| C. | 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 | |
| D. | 锂离子电池的比能量(单位质量释放的能量)低 |
查看答案和解析>>
科目: 来源: 题型:选择题
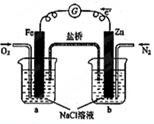
| A. | 向烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成 | |
| B. | 烧杯b中发生反应为Zn+2e-=Zn2+ | |
| C. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| D. | 烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com