
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 淀粉胶体加入电解质可发生聚沉现象 | |
| B. | 向Fe(OH)3胶体中加入少量H2SO4溶液,会生成红褐色沉淀 | |
| C. | 可利用丁达尔效应区分胶体与溶液 | |
| D. | 胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液和胶体的本质区别是能否产生丁达尔现象 | |
| B. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| C. | 江河入海口处易形成三角洲,这与胶体的性质有关 | |
| D. | 胶体的分散质不能通过滤纸 |
查看答案和解析>>
科目: 来源: 题型:解答题
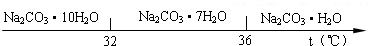
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
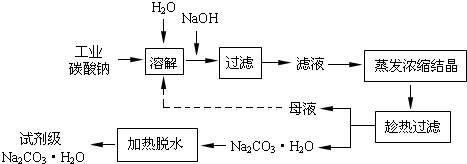
查看答案和解析>>
科目: 来源: 题型:解答题


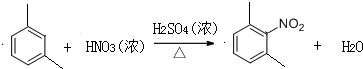 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
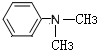 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:解答题
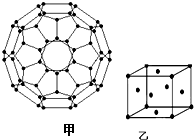 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目: 来源: 题型:解答题
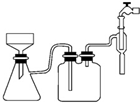 阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(
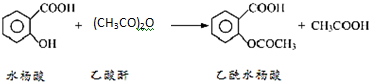
阿司匹林口服时,具有解热镇痛作用,是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄.近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成;它的有效成分是乙酰水杨酸(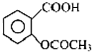 ).
).
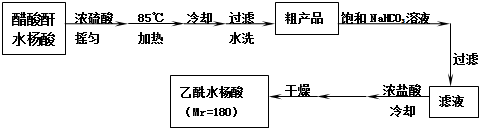
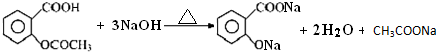
查看答案和解析>>
科目: 来源: 题型:解答题
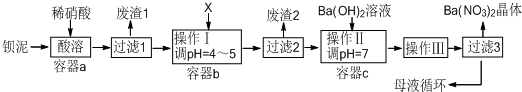
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com