
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
A.反应①的平衡常数K1=[c(C O2)•c(Cu)]/[c(CO)•c(CuO)]
O2)•c(Cu)]/[c(CO)•c(CuO)]
B.对于反应③,恒容时,温度升高,H2的浓度减小,则该反应的焓变为正值
C.反应③的平衡常数K=K1/K2
D.对于反应③,恒温恒容下,增大压强,H2的浓度一定减小
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法错误的是
A.增大反应物的浓度,可增大活化分子的百分数,从而使反应速率增大
B.决定化学反应速率的主要因素是参加反应的物质的性质
C.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)ΔH=+185.57kJ•mol?1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
D.升温能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列与金属腐蚀有关的说法正确的是
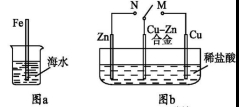
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨,已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是

A.电路中通过1mol电子时,Y电极质量增加48g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-===PbSO4(s)+2H2O(l)
C.c、d电极产生气体的物质的量之比为1∶2
D.X极为负 极
极
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法正确的是
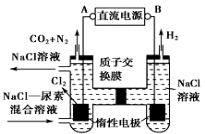
A.B为电源的正极
B.电解结束后,阴极室溶液的pH升高
C.电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A
D.阳极室中发生的反应依次为2Cl﹣﹣2e﹣=Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
如图所示,下列叙述正确的是

A. Y为阴极,发生还原反应 B. X处有O2生成
C. Y与滤纸接触处有氧气生成 D. X与滤纸接触处变红
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
以Pt为电极,电解含有0.10molM+和0.10molN3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)

A.M+>H+>N3+
B .M+>N3+>H+
.M+>N3+>H+
C.N3+>H+>M+
D.条件不足,无法确定
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
用惰性电极电解物质的量浓度相同、体积比为3∶1的CuSO4溶液和NaCl溶液的混合溶液,不可能发生的反应是
A.2Cu2++2H2O 2Cu+4H++O2↑
2Cu+4H++O2↑
B.Cu2++2Cl- Cu+Cl2↑
Cu+Cl2↑
C.2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:实验题
利用如图装置测定中和热的实验步骤如下:

①量取50mL0.25mol/LH2SO4溶液倒入小烧杯中,测量温度;
②量取50mL0.55mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)如右图所示,仪器A的名称是_______________;
(2)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃[ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_________ (填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则C H3COOH在水溶液中电离的ΔH等于_________
H3COOH在水溶液中电离的ΔH等于_________
A.-67.7kJ·mol-1 B.-43.5kJ·mol-1
C.+43.5kJ·mol-1 D.+67.7kJ·mol-1
查看答案和解析>>
科目: 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+ O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+ O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图:

①请计算每生成1molNH3放出热量为:_________.
②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com