
科目: 来源: 题型:选择题
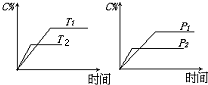 可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 达平衡后,若升温,平衡向逆方向移动 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,增加A的量有利于平衡向正方向移动 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 保持温度和容器压强不变,充入1 mol NH3(g) | |
| B. | 保持温度和容器体积不变,充入1 mol NH3(g) | |
| C. | 保持温度和容器压强不变,充入1 mol N2(g) | |
| D. | 保持温度和容器体积不变,充入1 mol Ar(g) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2NO2(g)?N2O4(g)(正反应为放热反应) | |
| B. | 2SO3(g)?2SO2(g)+O2(g)(正反应为吸热反应) | |
| C. | H2(g)+I2(g)?2HI (g)(正反应为放热反应) | |
| D. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) (正反应为放热反应) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在饱和氯水中通入H2S气体,溶液的pH变小 | |
| B. | 在饱和氯水中通入SO2气体,溶液的pH变小 | |
| C. | 在饱和氯水中加入CaCO3,平衡向右移,溶液的pH变大 | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中微粒浓度:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水;无水CaCl2 固体 | B. | 饱和NaHCO3 溶液; 浓H2SO4 | ||
| C. | 浓H2SO4; 饱和NaHCO3 溶液 | D. | 饱和NaHCO3 溶液; 稀H2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正极发生的电极反应为:3O2+6CO2+12e-═6CO${\;}_{3}^{2-}$ | |
| B. | 通入乙烯的一极为正极 | |
| C. | 负极发生的电极反应为:CH2=CH2+6CO${\;}_{3}^{2-}$-12e-═8CO2+2H2O | |
| D. | 电池的总反应式为:CH2=CH2+3O2═2CO2+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com