
科目: 来源: 题型:选择题
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| C. | 50ml 18.4mol/L浓硫酸与足量铜微热,生成气体0.46NA | |
| D. | 25℃时,7g C2H4和C3H6的混合气体中,含有NA个C-H键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用食醋清除暖水瓶中的水垢 | |
| B. | 纤维素在人体内可水解为葡萄糖,故可作为人类的营养物质 | |
| C. | 用热的纯碱水洗涤油垢 | |
| D. | 葡萄糖中花青素在碱性环境下显紫色,故可用苏打粉打粉检验假红酒 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含1.2NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的物质的量浓度为0.6mol•L-1 | |
| B. | Na在空气中长期放置变成Na2CO3粉末 | |
| C. | 过量的澄清石灰水分别与Na2CO3溶液和NaHCO3溶液反应,现象不同 | |
| D. | 滴加KSCN显红色的溶液中可大量存在NH4+、K+、Cl-、I- |
查看答案和解析>>
科目: 来源: 题型:解答题
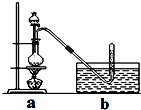
查看答案和解析>>
科目: 来源: 题型:解答题
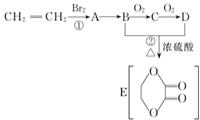 由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)
由乙烯和其他无机原料合成环状酯,其合成过程如下(水及其他无机产物均已省略)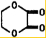 +2H2O.
+2H2O.查看答案和解析>>
科目: 来源: 题型:填空题
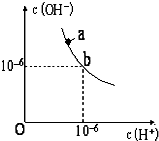 回答下列问题.
回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 2.5×104:2 | D. | 2.5×104:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠保存在煤油中 | |
| B. | 白磷保存在水中 | |
| C. | 在FeCl3 溶液中加入一定量铁粉,防止溶液变质 | |
| D. | 为了检验FeCl2溶液是否变质,可用KSCN 溶液检验 |
查看答案和解析>>
科目: 来源: 题型:解答题
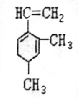 己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.
己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.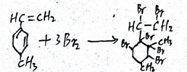 ;
;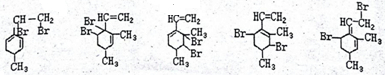 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4L 0.5 mol/L NaCl 溶液 | B. | 1L 0.3 mol/L Na2SO4 溶液 | ||
| C. | 0.8L 0.4 mol/L NaOH 溶液 | D. | 2L 0.15 mol/L Na3PO4 溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com