
科目: 来源: 题型:选择题
| A. | 反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中1molMnO2被氧化转移2mol电子 | |
| B. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| C. | NaHSO4在熔融状态下的电离方程式为:NaHSO4═Na++HSO4- | |
| D. | 需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知C2H2(g)+$\frac{5}{2}$O2(g)→2CO2(g)+H2O(l)△H=-1300KJ/mol 当有5NA个电子转移时能放出650KJ的热量 | |
| B. | 有28g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 有反应H2(g)+I2(g)?2HI(g)△H=-QHJ/mol在298K 101KPa下向一密闭容器中充入NA个H2和NA个I2,充分反应共放出热量为QKJ | |
| D. | 在78g苯中含3NA个碳碳双键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 产生BaSO4白色沉淀,溶液变红色 | B. | 产生BaSO3白色沉淀,溶液变无色 | ||
| C. | 无沉淀产生,溶液变无色 | D. | 产生BaSO4白色沉淀,溶液变无色 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去CO2中混有的HCl:用碳酸钠溶液洗气 | |
| B. | 通过碱石灰固体除去SO2中的水蒸气 | |
| C. | 除去氯化钠中混有的氯化铵:用加热法 | |
| D. | 除去NaHCO3中混有的Na2CO3:用加热法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在水中的溶解性:NaHCO3<Na2CO3 | |
| B. | 相同条件下,与等浓度盐酸反应生成CO2的速率:NaHCO3<Na2CO3 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出CO2更多 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应产生的CO2质量相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:解答题
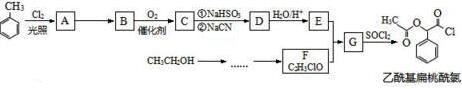
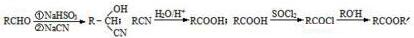
 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$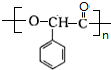 +nH2O.
+nH2O.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com