
科目: 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②④⑤ | C. | ②③④⑤ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 1mol/L的Mg(NO3)2溶液中含有的NO3-的数目为2 NA | |
| C. | 铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA | |
| D. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaHCO3溶液中加入过量的石灰水产生白色沉淀:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向AgCl悬浊液中滴加Na2S溶液产生黑色沉淀:2AgCl(s)+S2-═Ag2S(s)+2Cl- | |
| C. | 石灰乳中Ca(OH)2的电离:Ca(OH)2(s)═Ca2++2OH- | |
| D. | Fe(OH)3胶体的制备:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl |
查看答案和解析>>
科目: 来源: 题型:解答题
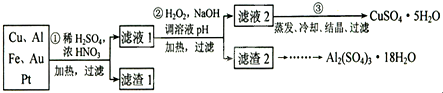
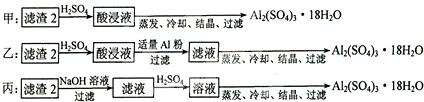
查看答案和解析>>
科目: 来源: 题型:解答题
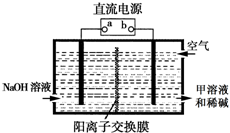 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.查看答案和解析>>
科目: 来源: 题型:解答题
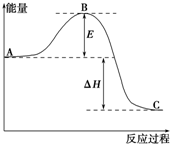 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电离时能够产生H+的化合物是酸 | |
| B. | 难溶的物质(如CaCO3)不能发生离子反应 | |
| C. | 电解质在水中不一定能导电,在水中导电的化合物不一定是电解质 | |
| D. | 胶体加入电解质可产生沉淀,而溶液不能 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 维生素C具有还原性 | |
| B. | 上述过程中砷元素发生还原反应 | |
| C. | 上述过程中+5价砷类物质作氧化剂 | |
| D. | 上述过程中+3价砷类化合物是氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com