
科目: 来源: 题型:解答题
 某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:
某研究小组将纯净的SO2气体通入0.1mol•L?1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组进行了如下假设:| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
| 实验步骤 | 实验现象 | 结论 |
| 假设二成立 | ||
查看答案和解析>>
科目: 来源: 题型:解答题
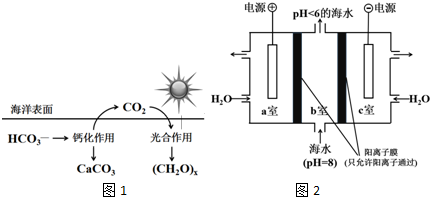
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去硬脂酸钠溶液中的甘油方法是:往溶液中加入饱和食盐水,分液 | |
| B. | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去,证明生成的气体全部是乙烯 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从下口倒出,重复2~3次 | |
| D. | 取5mL0.1mol•L-1KI溶液,滴加0.1mol•L-1FeCl3溶液5~6滴,继续加入2mLCCl4,充分振荡后静置,取上层溶液加KSCN溶液,无明显现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 正反应进行的程度大、正反应速率一定大 | |
| C. | 化学平衡发生移动时、化学反应速率一定变化 | |
| D. | 只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 | 温度(℃) | H2(mol) | N2(mol) | 催化剂 |
| A | 450 | 3 | 1 | 无 |
| B | 450 | 3 | 1 | 有 |
| C | 500 | 6 | 2 | 有 |
| D | 500 | 6 | 2 | 无 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | NO2通入水中,红棕色逐渐褪去 | |
| C. | 往硝酸银溶液中滴加盐酸产生白色沉淀 | |
| D. | 甲烷和氯气在光照下反应,黄绿色逐渐褪去 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用丁达尔效应区分胶体和溶液 | |
| B. | 用量筒量取5.0mL浓硫酸,并直接加水稀释 | |
| C. | 用分液漏斗分离苯和水的混合物 | |
| D. | 用托盘天平称量药品时,左盘放物品,右盘放砝码 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1-丁烯和2-甲基-1-丁烯 | B. | 己烷和环己烷 | ||
| C. | 尿素CO(NH2)2和氰酸铵 (NH4CNO) | D. | 乙苯和丙苯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MgCO3(s)═MgO(s)+CO2(g)△H=+1.366 kJ/mol | |
| B. | MgCO3(s)═MgO(s)+CO2(g)△H=-1.366 kJ/mol | |
| C. | MgCO3(s)═MgO(s)+CO2(g)△H=-114.7 kJ/mol | |
| D. | MgCO3(s)═MgO(s)+CO2(g)△H=+114.7 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com