
科目: 来源: 题型:选择题
| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.05NA | |
| B. | 常温下,1 L0.1mol/L的Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| C. | 标准状况下,22.4 L CO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1mol FeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 杜绝食品添加剂符合“绿色化学”的理念 | |
| B. | 医用酒精用来消毒,利用了其氧化性 | |
| C. | 一支钢笔使用两种不同型号的墨水易堵塞,这与胶体性质有关 | |
| D. | 铝或铝合金可制作餐具,是因为表面形成了耐酸、碱、盐腐蚀的保护膜 |
查看答案和解析>>
科目: 来源: 题型:解答题
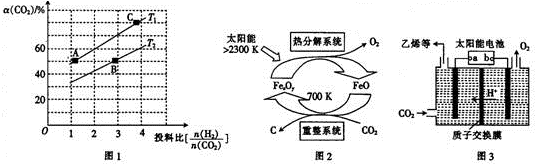
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两溶液中c(OH-):①>② | B. | 两溶液中阳离子数目:②是①的2倍 | ||
| C. | ①溶液中:c(CO32-)<c(H2CO3) | D. | ②溶液中:c(HCO3-)<c(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:解答题
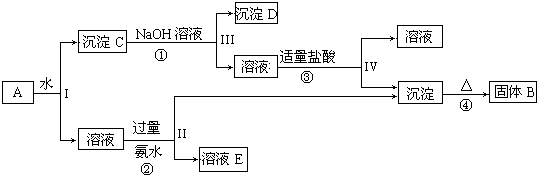
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3和盐酸 | B. | AlCl3和NaOH | C. | NaAlO2和硫酸 | D. | Na2CO3和BaCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5Cl2+I2+6H2O=10HCl+2HIO3 | B. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | ||
| C. | MnO2+4HCl=MnCl2+2H2O+Cl2↑ | D. | 2KClO3=2KCl+3O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com