
科目: 来源: 题型:选择题
| A. | KN03 | B. | NH4NO3 | C. | CaC2 | D. | P4(白磷) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑤ | B. | ①④ | C. | ②③ | D. | ②③⑥ |
查看答案和解析>>
科目: 来源: 题型:填空题
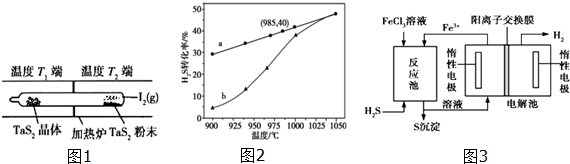
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的盐酸中,含HCl分子数为NA | |
| B. | 0.1 mol Na2O2与水完全反应,转移0.2NA个电子 | |
| C. | 8.4gNaHCO3固体中含HCO3-数目为0.1 NA | |
| D. | 将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀的正极反应:2H++2e-═H2↑ | |
| B. | 钢铁发生吸氧腐蚀的负极反应:Fe-3e-═Fe3+ | |
| C. | 自行车的钢圈上镀一层铬,防止生锈 | |
| D. | 外加直流电源保护钢闸门时,钢闸门与直流电源的负极相连 |
查看答案和解析>>
科目: 来源: 题型:解答题
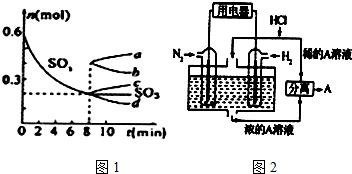
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温常压下,0.2molNa2O2中含有0.4NA个阴离子 | |
| B. | 常温常压下,0.2molSi与足量NaOH溶液反应,转移电子的数目为0.2NA | |
| C. | 物质的量浓度为0.5mol/L的FeCl3溶液中,含有Cl-个数为1.5NA | |
| D. | 常温常压下,1.06g Na2CO3中含有的Na+离子数为0.02NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com