
科目: 来源: 题型:填空题
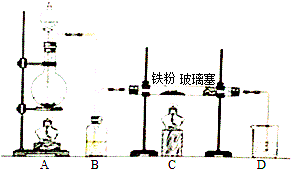 计算:
计算:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 醋酸溶液中存在H+、CH3COOH、CH3COO-等微粒,故醋酸是弱电解质 | |
| B. | “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成可溶性的Ca(HCO3)2的缘故 | |
| C. | 硫酸、纯碱、小苏打和二氧化硫分别属于酸、碱、盐和酸性氧化物 | |
| D. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 |
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2 和 H2在一定条件下反应生成NH3 | |
| B. | NO遇O2 转化为NO2 | |
| C. | 硝酸工厂用NH3 氧化制取NO | |
| D. | 由NH3 制取碳酸铵 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入Mg能放出H2的溶液K十、Al3+、Cl一、SO42- | |
| B. | 存在较多的H十、SO42-、NO3-的溶液中Fe3+、CH3COO-、Cl- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:SO32-、NH4+、NO3-、Na+ | |
| D. | 使甲基橙呈红色的溶液NH4+、K+、[Al(OH)4]-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
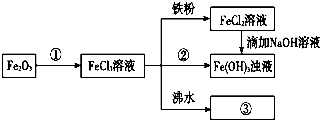
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 还原剂只有锂 | |
| B. | SOCl2中每个原子都达到8电子稳定结构 | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | 生成1.12 LSO2时,反应转移电子为0.2 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
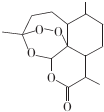
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素可溶于NaOH溶液,可使酸性高锰酸钾溶液褪色 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com