
科目: 来源:0118 期中题 题型:计算题
查看答案和解析>>
科目: 来源:同步题 题型:填空题
 2B(g)+C(g),2D(g)+C(g)
2B(g)+C(g),2D(g)+C(g) 2E(g) tmin时建立平衡,平衡时测得B的物质的量为mmol,C的物质的量为n mol,试回答:
2E(g) tmin时建立平衡,平衡时测得B的物质的量为mmol,C的物质的量为n mol,试回答: 查看答案和解析>>
科目: 来源:0101 期中题 题型:单选题
查看答案和解析>>
科目: 来源:0123 模拟题 题型:填空题

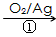
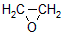
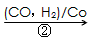 HOCH2CH2CHO
HOCH2CH2CHO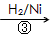 HOCH2CH2CH2OH
HOCH2CH2CH2OH 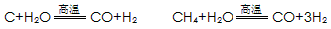
查看答案和解析>>
科目: 来源:专项题 题型:填空题
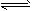 3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。求:
3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。求:查看答案和解析>>
科目: 来源:0108 期末题 题型:填空题
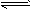 xC(g)。2min后达平衡,剩余0.8molB,C的浓度为0.4mol/L。
xC(g)。2min后达平衡,剩余0.8molB,C的浓度为0.4mol/L。 查看答案和解析>>
科目: 来源:同步题 题型:计算题
 2NH3(g)。
2NH3(g)。查看答案和解析>>
科目: 来源:0106 期中题 题型:填空题
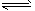 2NH3(g) ΔH=-92.2 kJ·mol-1。平衡时容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ·mol-1。平衡时容器内气体压强为起始时的80%。查看答案和解析>>
科目: 来源:安徽省期中题 题型:计算题
查看答案和解析>>
科目: 来源:山西省月考题 题型:单选题
 2NH3(g) △H=-92 kJ/mol 。实验测得起始、平衡时有关数据如下
2NH3(g) △H=-92 kJ/mol 。实验测得起始、平衡时有关数据如下 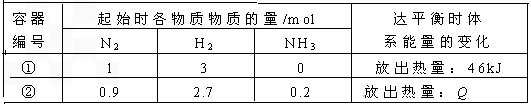
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com