
科目: 来源: 题型:选择题
| A. | 由题目信息知:KMnO4的氧化性比MnO2的强 | |
| B. | 制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 | |
| C. | 用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 | |
| D. | 用足量MnO2与含有4 molHCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
查看答案和解析>>
科目: 来源: 题型:解答题
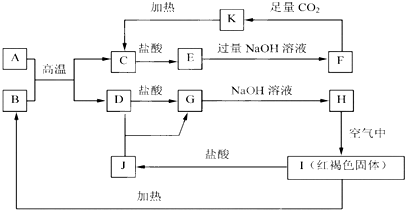
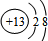 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2分子的比例模型: | |
| B. | 过氧化氢的电子式: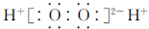 | |
| C. | 氟原子的结构示意图: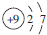 | |
| D. | H2CO3的电离方程式:H2CO3?2H++CO32- |
查看答案和解析>>
科目: 来源: 题型:解答题
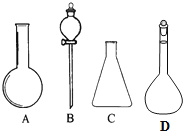 由图所示A、B、C、D四种仪器,回答下列问题.
由图所示A、B、C、D四种仪器,回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
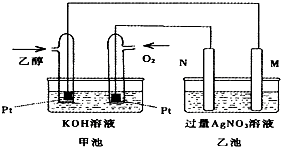
| A. | 若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极 | |
| B. | 甲池中负极的电极反应式为:CH3CH2OH-12e-+3H2O=2CO2+12H+ | |
| C. | 甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.04g | |
| D. | M电极上的电极反应式为:Ag++e-=Ag |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 35g | B. | 30g | C. | 20g | D. | 15g |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| B. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| C. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 图中pH=7时c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
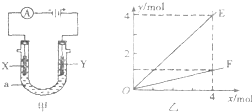 电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )
电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
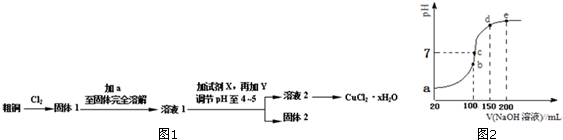
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com