
科目: 来源: 题型:选择题
| A. | 10mL 1mol/L FeCl3溶液 | B. | 50mL 0.3mol/L NaCl溶液 | ||
| C. | 10mL 0.2mol/L CaCl2溶液 | D. | 200mL 0.1mol/L NH4Cl溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
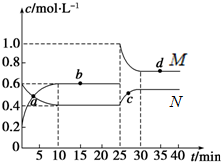 W、X、Y、Z分别为H、C、N、O元素.
W、X、Y、Z分别为H、C、N、O元素.查看答案和解析>>
科目: 来源: 题型:解答题
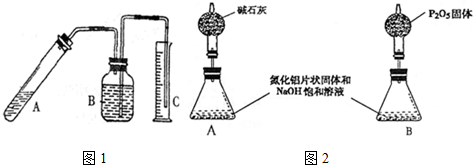
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgCl是还原产物 | |
| B. | 负极的电极反应为:Ag+Cl--e-═AgCl | |
| C. | Na+不断向“水”电池的正极移动 | |
| D. | 每生成1mol Na2Mn5O10转移2mol电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
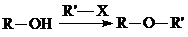 ②
②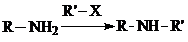
 试剂W
试剂W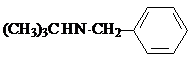 .
.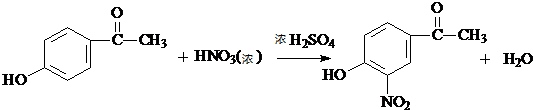 .
.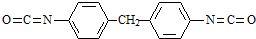 生成高聚物的结构简式
生成高聚物的结构简式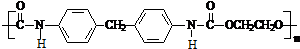 .
.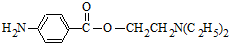 (无机试剂任用)(合成路线表示方式为:反应试剂A反应条件B…反应试剂反应条件目标产物)
(无机试剂任用)(合成路线表示方式为:反应试剂A反应条件B…反应试剂反应条件目标产物)查看答案和解析>>
科目: 来源: 题型:选择题
 分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )
分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )| A. | 该图表示的是乙烯分子的球棍模型 | |
| B. | 该烃分子是非极性分子 | |
| C. | 该烃的电子式为: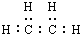 | |
| D. | 该烃分子中半径较大的原子其核外电子排布的轨道表示式为: |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯酚遇石蕊显红色 | B. | 食用花生油能发生水解反应 | ||
| C. | 包装用材料聚氯乙烯属于烃 | D. | PX项目中的对二甲苯属于饱和烃 |
查看答案和解析>>
科目: 来源: 题型:解答题
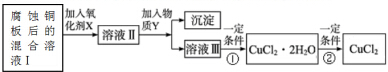
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
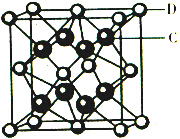 已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.F原子核外最外层电子数与Na相同,其余各层电子均充满.
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.F原子核外最外层电子数与Na相同,其余各层电子均充满.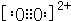 ,1mol B22+中含有的π键数目为2NA.
,1mol B22+中含有的π键数目为2NA. 该离子化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德罗常数的值为NA).
该离子化合物晶体的密度为a g/cm3,则晶胞的体积是$\frac{312}{a{N}_{A}}$ cm3(只要求列算式,阿伏加德罗常数的值为NA).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com