
科目: 来源: 题型:解答题
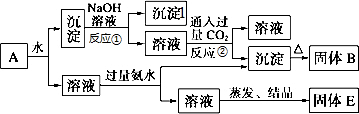
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 食盐加碘实质是在食盐中加入KIO3 | |
| C. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 | |
| D. | 焚烧垃圾会产生大量污染空气的物质,故不宜采用此法 |
查看答案和解析>>
科目: 来源: 题型:解答题
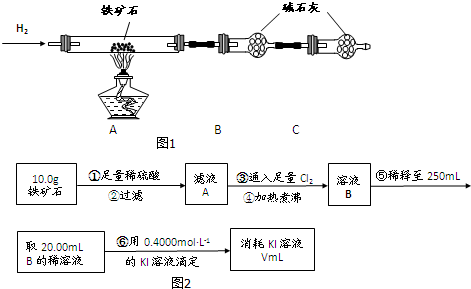
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化合物中一定没有非极性键 | |
| B. | 单质中不可能含有离子键 | |
| C. | 金属元素与非金属元素间形成的键均是离子键 | |
| D. | CO2、CH4分子中每个原子最外层均形成了8电子结构 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
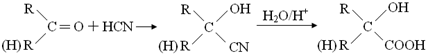
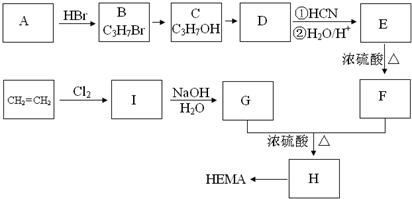
查看答案和解析>>
科目: 来源: 题型:解答题
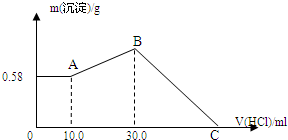 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com