
科目: 来源: 题型:解答题
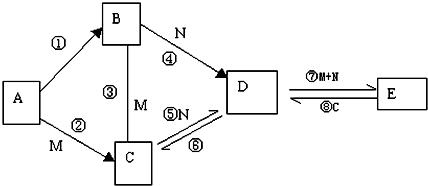
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
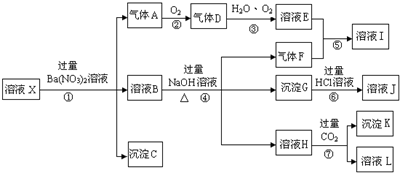
 ,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.查看答案和解析>>
科目: 来源: 题型:解答题
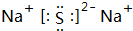 .
.查看答案和解析>>
科目: 来源: 题型:选择题
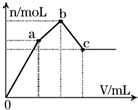
| A. | Na2SO4与NaAlO2组成的混合物 | B. | KAl(SO4)2 | ||
| C. | Al2(SO4)3 | D. | NH4Al(SO4)2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:解答题
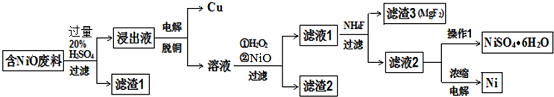
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀 | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
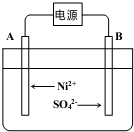
科目: 来源: 题型:选择题

| A. | 原电池的总反应为Fe+Cu2+═Fe2++Cu | |
| B. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-═H2↑ | |
| D. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2mol电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
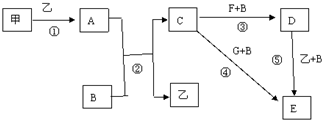
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com