
科目: 来源: 题型:解答题
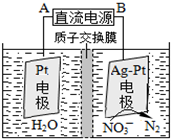 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
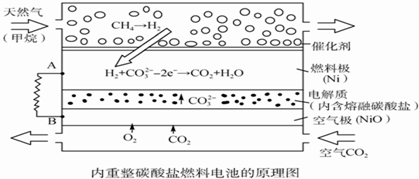
| A. | 以此电池为电源电解精炼铜,当有0.1 mol e-转移时,有3.2 g铜溶解 | |
| B. | 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-═CO32-+2H2O | |
| C. | 该电池使用过程中需补充Li2CO3和K2CO3 | |
| D. | 空气极发生的电极反应式为O2+4e-+2CO2═2CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的正极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目: 来源: 题型:解答题
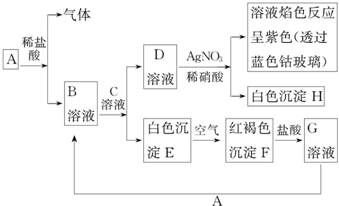
查看答案和解析>>
科目: 来源: 题型:解答题
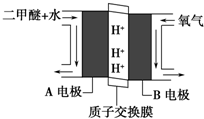 (1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.
(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.查看答案和解析>>
科目: 来源: 题型:选择题
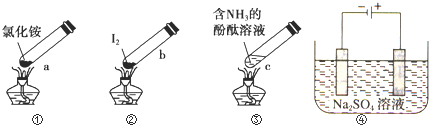
| A. | 加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好 | |
| B. | 加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 | |
| C. | 加热时,c中溶液红色变深,冷却后又变浅 | |
| D. | ④左侧为e右侧为f,在惰性电极e和f附近分别滴加紫色石蕊试液,e电极附近呈红色,f电极附近呈蓝色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为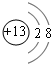 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com