
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题


 .
.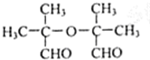 .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 若电键K与N连接,铁被保护不会腐蚀 | |
| B. | 若电键K与N连接,正极反应式是4OH--4e-═2H2O+O2↑ | |
| C. | 若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 | |
| D. | 若电键K与M连接,当两极共产生22.4L(标准状况)气体时,生成了1mol NaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 氢氧燃料电池的负极通入的是氢气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
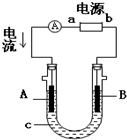 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:解答题
 在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol
在一定条件下,N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨分解为氢气和氮气的热化学方程式2NH3(g)=N2(g)+3H2(g)△H=+92KJ/mol查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
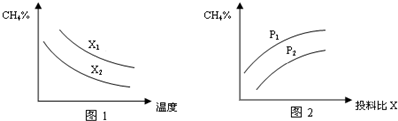
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com