
科目: 来源: 题型:选择题
| A. | 酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中能量变化的大小与反应物的质量无关 | |
| C. | 伴有能量变化的过程都是化学变化 | |
| D. | 化学反应中的能量变化,主要是由化学键变化引起的 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
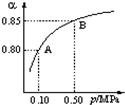 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.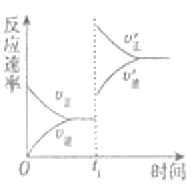
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 改变条件 | 平衡移动方向 | 导电能力 |
| A | 加入蒸馏水 | 逆向移动 | 减弱 |
| B | 加入少量冰醋酸 | 正向移动 | 增强 |
| C | 加入少量CH3COONa固体 | 正向移动 | 增强 |
| D | 加入少量0.1mol•L-1的稀硫酸 | 逆向移动 | 减弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
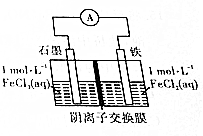
| A. | FeCl3和FeCl2可以互换位置,对反应无影响 | |
| B. | 该电池总反应为FeCl3+Fe═2FeCl2 | |
| C. | 若溶解2.8g铁,约有0.1molCl-从交换膜左向右迁移 | |
| D. | 一段时间后,阴膜左、右侧离子数变化量之比约为2:3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 分子式 | C3H8O | C4H8Cl2 | C7H16 | C8H10 |
| 限定条件 | 能使KMnO4溶液褪色 | 分子中含有2个甲基 | 分子中含有3个甲基 | 芳香烃、能得到三种一硝基化物 |
| 数目 | 2 | 3 | 2 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(HCO3-)=c(CO32-) | B. | 溶液中无H2CO3 | ||
| C. | c(HCO3-)恒定不变 | D. | 溶液中H2CO3、HCO3-、CO32-共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com