
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
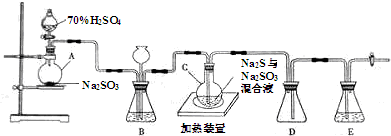
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 9.820g晶体中含有C2O42-的物质的量为0.006mol | |
| B. | 配制草酸合铁酸钾溶液玻璃仪器只需烧杯和玻璃棒 | |
| C. | 该晶体的化学式为K3Fe(C2O4)3•6H2O | |
| D. | 9.820g样品中含K+的物质的量为0.06 mol |
查看答案和解析>>
科目: 来源: 题型:解答题
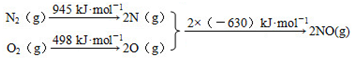

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下反应N2+3H2$?_{加热}^{催化剂}$2NH3,达到平衡时,3v正(H2)=2v正(NH3) | |
| B. | 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成 | |
| C. | 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3•H2O)变小 | |
| D. | 常温下,向浓度为0.1mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 金属 | Na | Cu | Al | Fe |
| 熔点/℃ | 97.5 | 1 083 | 660 | 1 535 |
| 沸点/℃ | 883 | 2 595 | 2 200 | 3 000 |
| A. | Cu与Na | B. | Fe与Cu | C. | Fe与Al | D. | Al与Na |
查看答案和解析>>
科目: 来源: 题型:解答题
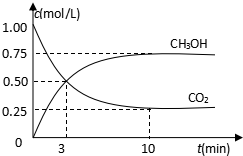 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在485℃时,在体积为1L的密闭容器中,充入1ol CO2和3mol H2,一定条件下发生反应合成甲醇:查看答案和解析>>
科目: 来源: 题型:选择题
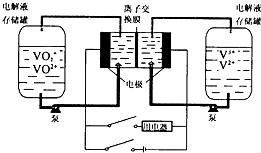
| A. | 充电时阴极的电极反应是V3++e-=V2+ | |
| B. | 放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被被氧化 | |
| C. | 若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol | |
| D. | 若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com