
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙烯所含共用电子对数为5NA | |
| B. | 72g Ca02所含离子总数为3NA | |
| C. | 常温下,将1mol Cl2通入到过量的NaOH溶液中,电子转移数目为NA | |
| D. | 1L0.1mol/L Na2C03溶液中,C032-数目为0.lNA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质用途 | 解释 | |
| A | 食醋浸泡水壶中的水垢 | 水垢中CaCO3溶于醋酸,酸性H2CO3>CH3COOH |
| B | 炒菜时加一点酒和醋 | 有酯类物质生成,使菜味香可口 |
| C | NaClO溶液可用作洗手液 | NaClO具有杀菌、消毒作用 |
| D | Al2O3可用作医药中的胃酸中和剂 | Al2O3能与胃酸反应,使胃液酸度降低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | 4个Cl-和2个NH3分子均与Pt4+配位 | |
| D. | 配合物中4个Cl-与Pt4+配位,而2个NH3分子与Pt4+不配位 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
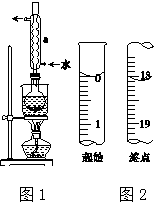 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 3:2 | B. | 4:3 | C. | 4:1 | D. | 2:l |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向50 mL 1 mol•L-1明矾溶液中滴入少量0.1 mol•L-1Ba(OH)2溶液Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ | |
| B. | 已知还原性Fe2+>Br-,a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2═Br2+2Fe3++4C1- | |
| C. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-═3I2+2H2O | |
| D. | 在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 陈述Ⅰ | 陈述Ⅱ | |
| A | BaSO4难溶于水 | SO2气体通入Ba(NO3)2溶液中沉淀 |
| B | 非金属性:Cl>S | 酸性:HClO3>H2SO4 |
| C | 常温下,NaHCO3的溶解度比Na2CO3小 | 向饱和Na2CO3溶液中通入CO2产生沉淀 |
| D | 常温下,SO2与氢硫酸和NaOH溶液均可反应 | SO2是两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com