
科目: 来源: 题型:解答题
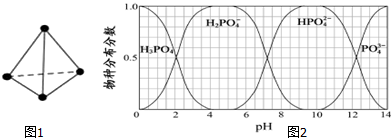
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目: 来源: 题型:解答题
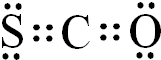 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠盐 | B. | 钾盐 | C. | 铁盐 | D. | 钙盐 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.01mol/L NH4Al(SO4)2溶液与0.01mol•L-1Ba(OH)2溶液等体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 将标准状况下的11.2L氯气通入200mL2mol•L-1的FeBr2溶液中,离子反应方程式为:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
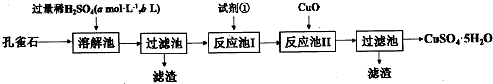
查看答案和解析>>
科目: 来源: 题型:解答题
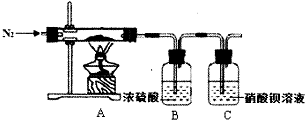 硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.
硫酸亚铁铵又称为摩尔盐,是一种重要的化工原料,其组成可表示为x(NH4)2S04•yFeS04•zH20.某兴趣小组探究组成中的x、y、z的数值.查看答案和解析>>
科目: 来源: 题型:解答题
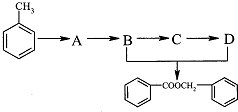
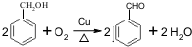
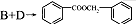 的化学方程式为
的化学方程式为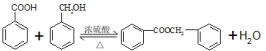
查看答案和解析>>
科目: 来源: 题型:选择题
 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:| A. | 溶液中一定含有NH4+、C032- | |
| B. | 溶液中离子浓度c(Na+)=c(S042一) | |
| C. | 溶液中一定不含Mg2+、Al3+、Fe3+ | |
| D. | 溶液可能是由Na2C03与(NH4)2S04组成的混合溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素金属性:Z>W | |
| B. | X与Y可形成多种共价化合物 | |
| C. | 化合物Z2Y2中既含离子键,又含共价键 | |
| D. | Y元素只能形成一种单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com