
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有大量AlO${\;}_{2}^{-}$的溶液中:Na+、OH-、Cl-、CO${\;}_{3}^{2-}$ | |
| B. | 滴加紫色石蕊试液变红的溶液中:K+、Ba2+、CH3COO-、F- | |
| C. | 加入Al能放出H2的溶液中:K+、NH4+、NO3-、HCO3- | |
| D. | 1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | KHCO3和MgCO3 | B. | K2CO3和Na2CO3 | C. | MgCO3和Na2CO3 | D. | KHCO3和NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
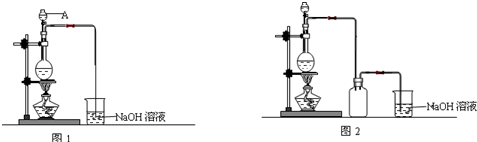
查看答案和解析>>
科目: 来源: 题型:解答题
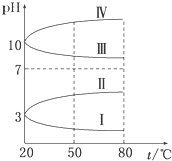 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C消耗的速率与A消耗的速率相等 | |
| B. | 单位时间内生成a mol B,同时消耗a mol C | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com