
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ④②①③ | B. | ①④③② | C. | ②③①④ | D. | ②④①③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠在空气中露置会立刻被空气氧化成过氧化钠 | |
| B. | 钠单质具有强还原性,可将铜从其盐溶液中置换出来 | |
| C. | 钠与钠离子都具有强的还原性 | |
| D. | 钠与稀盐酸反应的实质是与氢离子的反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.
,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.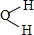 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3溶液中通入少量SO2:SO2+H2O+2CO32-═SO32-+2HCO3- | |
| B. | 漂白粉中滴加浓盐酸加热制取氯气:ClO-+Cl-+2H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Cl2+H2O | |
| C. | 将0.1mol•L-1的NH4Al(SO4)2溶液与0.2mol•L-1的Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═AlO2-↓+2BaSO4↓+2H2O | |
| D. | 含0.4molFeI2的溶液中通入0.3mol氯气:4Fe2++2I-+3Cl2═4Fe3++I2+6Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,A的结构式H-C≡C-H
,A的结构式H-C≡C-H 反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;
反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;查看答案和解析>>
科目: 来源: 题型:解答题
| 资料卡 NO:2006-KI-001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4-还原为Cl-、I-、Mn2+,如: H2SO3+I2+H2O═H2SO4+2HI |
查看答案和解析>>
科目: 来源: 题型:解答题
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com