
科目: 来源: 题型:解答题
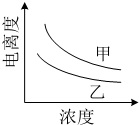 结合下表回答下列问题(均为25℃时的数据)
结合下表回答下列问题(均为25℃时的数据)| 酸 | 电离平衡常数(Ka) | 酸 | 电离平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
科目: 来源: 题型:选择题
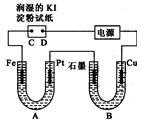 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )| A. | 电子流动的方向:Fe→Pt→石墨→Cu | |
| B. | B中石墨上可能有红色物质析出 | |
| C. | 若把Fe电极改成Ag电极,可向Pt上镀银 | |
| D. | t时A溶液的pH为3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ⑤②③①④ | B. | ④①③②⑤ | C. | ③⑤④①② | D. | ③④①⑤② |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 分别用炒锅加热两种样品,全部分解挥发,没有物质残留的是小苏打 | |
| B. | 先将两样品配成溶液,分别加入CaCl2,无白色沉淀生成的是小苏打 | |
| C. | 两只小玻璃杯,分别加入少量两种样品,再加入等浓度等体积的食醋,产生气泡快的是小苏打 | |
| D. | 先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
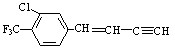 分子的下列叙述中,错误的是( )
分子的下列叙述中,错误的是( )| A. | 该物质使酸性高锰酸钾溶液褪色 | |
| B. | 一分子该物质能与6分子H2加成 | |
| C. | 最多有18个原子可能处在同一平面上 | |
| D. | 分子式为C11H6ClF3 |
查看答案和解析>>
科目: 来源: 题型:填空题
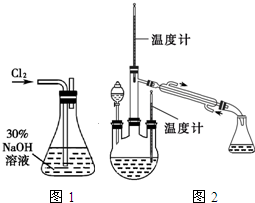 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com