
科目: 来源: 题型:选择题
| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入过量的铁粉 | |
| C. | Fe在氯气中燃烧后的产物 | |
| D. | 过量Fe粉放入FeCl3溶液中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| B. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| C. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| D. | 通过化学变化可以实现235U与238U的相互转化 |
查看答案和解析>>
科目: 来源: 题型:选择题
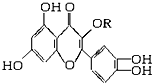 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入甲烷的电极为电池的负极,通入氧气的电极为正极 | |
| B. | 在标准状况下,每消耗5.6 L O2,可向外提供2.4×104 C的电量 | |
| C. | 通入甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O | |
| D. | 放电一段时间后,溶液的pH减小 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加NH4Cl溶液 | B. | 加浓氨水 | C. | 加水稀释 | D. | 加NaOH溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者所用时间少 | |
| B. | 常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-) 之比为2:1 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c{(OH}^{-})}{c{(H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
查看答案和解析>>
科目: 来源: 题型:解答题
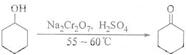
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com