
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
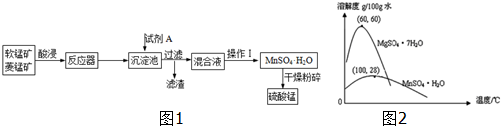
| A. | 试剂A应该选择H2O2,目的是将Fe2+氧化为Fe3+ | |
| B. | 试剂A应该选择氨水,目的是调节溶液的pH | |
| C. | 操作I包括蒸发、冷却、结晶、趁热过滤、洗涤、等步骤,洗涤时可用稀硫酸做洗液 | |
| D. | 在蒸发结晶时,温度应该高于60°C |
查看答案和解析>>
科目: 来源: 题型:解答题
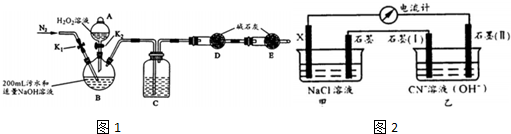
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热 |
| 步骤2 | 关闭K2,用注射器穿过B装置的胶塞注入 稀H2S04溶液 |
| 步骤3 | 打开K1,通入N2 |
| 实验序号 | 电极(X) | NaCl溶液浓度 (mol/L) | 甲中石墨表面通入气体 | 电流计读数 (A) |
| (1) | Fe | 0.1 | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5I |
| (3) | Fe | 0.1 | O2 | 2I |
| (4) | Al | 0.5 | 空气 | 1.6I |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: A,、Na2S B,、Na2CO3 C,、Na2SO4 D,、Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. ④向滤液滴加2滴淀粉溶液,再逐滴加0.1000mol•L-1碘的标准溶液,消耗碘的标准溶液体积为18.10mL. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3Na2S, 一定不含有Na2SO4. 操作④发生的反应是: 2S2O32-+I2═S4O${\;}_{6}^{2-}$+2I- Ⅰ、判断达到滴定终点的现象是溶液由无色变蓝色,且半分钟不褪色 Ⅱ、产品纯度:(9/W)×100%. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如表:| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1000mL 50.0g | B. | 950mL 47.5g | C. | 950mL 30.4g | D. | 1000mL 32.0g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 异戊烷和异戊二烯都能使溴水层褪色 | |
| C. | 亚硫酸钠和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 活性炭与氢氧化钠溶液都能使二氧化氮气体褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 淀粉溶液中滴入碘水--变蓝色 | B. | 溴化银见光分解--变黑色 | ||
| C. | 苯酚溶液中滴入Fe 3+--变紫色 | D. | 胆矾空气中久置--变白色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com