
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳和水反应吸收131.3kJ能量 | |
| B. | 1mol碳和1mol水反应生成 一氧化碳和氢气,并吸收131.3kJ热量 | |
| C. | 1mol C(S)和1 mol H2O(g)的能量总和大于1mol H2(g)和1mol CO(g)的能量 | |
| D. | 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶的性质 |
查看答案和解析>>
科目: 来源: 题型:解答题
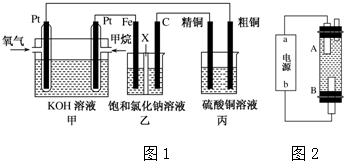
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2A+3B═2C | B. | A+3B═2C | C. | 3A+B═2C | D. | 3A+2B═3C |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单位时间内消耗amolA,同时生成3amolC | |
| B. | 容器的压强不再变化 | |
| C. | 混合气体的物质的量不再变化 | |
| D. | C的生成速率与B的生成速率的比为3:2 |
查看答案和解析>>
科目: 来源: 题型:解答题
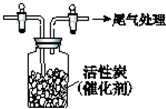 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目: 来源: 题型:解答题
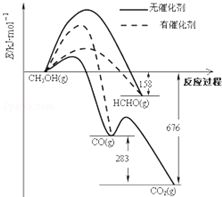 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去).| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com