
科目: 来源: 题型:解答题
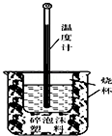 某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:
某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 ,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.
,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.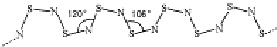
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔融态的A中阴离子有2种 | |
| B. | C溶于水会促进水的电离 | |
| C. | 将A溶液滴入B溶液中,能使B溶液中阳离子浓度增大 | |
| D. | B溶液的焰色反应呈黄色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将标准状况下1.12 L NH3溶于500 mL水中 | |
| B. | 将标准状况下1.12 L NH3溶于水配成500 mL溶液 | |
| C. | 取1 mol•L-1的氨水50 mL,加入500 mL水中 | |
| D. | 取1 mol•L-1的氨水100 mL,配成1 000 mL溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
查看答案和解析>>
科目: 来源: 题型:填空题
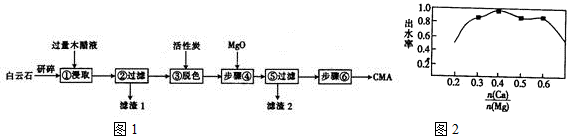
 对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:
对低品位的菱镁矿(主要成份是MgCO3和CaCO3)的综合利用意义重大.矿石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离.碳化反应的化学方程式如下:查看答案和解析>>
科目: 来源: 题型:填空题
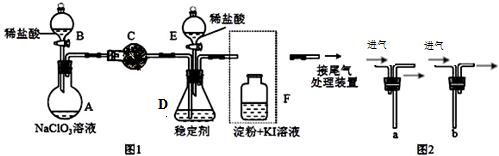

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com