
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | 只有④ |
查看答案和解析>>
科目: 来源: 题型:选择题
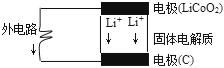 锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )
锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )| A. | 该电池的负极为LiCoO2 | |
| B. | 电池中的固体电解质可以是熔融的氯化钠、干冰等 | |
| C. | 充电时的阴极反应:Li1-xCoO2+xLi++xe-═LiCoO2 | |
| D. | 外电路上的“→”表示放电时的电子流向 |
查看答案和解析>>
科目: 来源: 题型:选择题
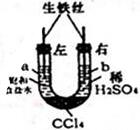 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a处、b处溶液的pH都增大 | |
| D. | a、b两处具有相同的电极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
科目: 来源: 题型:多选题
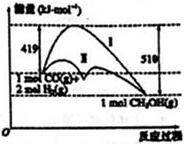 已知某反应过程在不同条件下的能量变化情况如图所示(改变的条件仅为催化剂),下列判断错误的是( )
已知某反应过程在不同条件下的能量变化情况如图所示(改变的条件仅为催化剂),下列判断错误的是( )| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 曲线Ⅰ和曲线Ⅱ相比较,曲线Ⅱ使用了催化剂 | |
| C. | 该反应可以表示为:CO(g)+2H2(g)?CH3OH(g)△=0.91KJ•mol-1 | |
| D. | 如果该反应生成液态CH3OH,则△H增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 其他条件不变,减小容器体积,平衡不移动 | |
| B. | 其他条件不变,增大c(A),A的转化率增大 | |
| C. | 降低温度,v正增大,v逆减小 | |
| D. | v正(A)═2v逆(C) |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com