
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2 L SO3中含有0.5NA个SO3分子 | |
| B. | 48g O3气体含有3NA个氧原子 | |
| C. | 在1L0.5mol•L-lFeCl3溶液中含有0.5NA个Fe3+ | |
| D. | 1.5 mol NO2与足量水反应,转移的电子数为1.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚氯乙烯塑料制品可用于食品包装 | |
| B. | H7N9型禽流感病毒在高温条件下被杀死的过程是蛋白质变性 | |
| C. | 高纯度的硅单质用于制作光导纤维,光导纤维有导电性 | |
| D. | 研发使用高效催化剂,可提高反应中原料的转化率 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
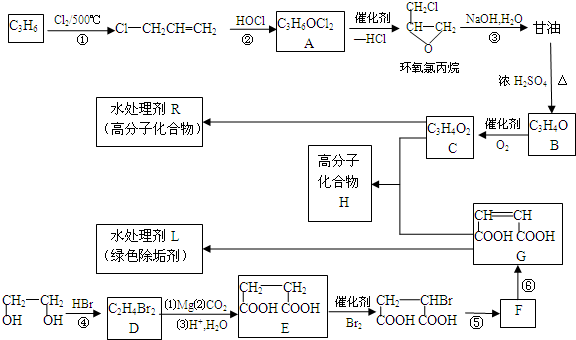
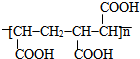 .
.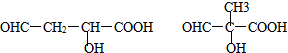
 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
科目: 来源: 题型:解答题
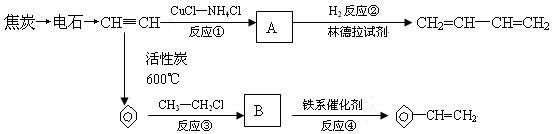
 .
. 、
、 .
.查看答案和解析>>
科目: 来源: 题型:解答题
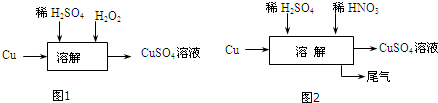
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |


查看答案和解析>>
科目: 来源: 题型:解答题
| 钠 | Na2CO3 | 金刚石 | 石墨 | |
| 熔点(℃) | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
查看答案和解析>>
科目: 来源: 题型:解答题
 硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:
硫化钠是一种重要的化工原料.工业上用硫酸钠与碳反应得到硫化钠.反应方程式如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com