
科目: 来源: 题型:多选题
| A. | 加热 | B. | 加入催化剂 | C. | 减小压强 | D. | 增加C的物质的量 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述不正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述不正确的是( )| A. | t2时,反应到达限度 | B. | t2-t3,反应仍在进行 | ||
| C. | t1时,只有正方向反应 | D. | t2-t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲、乙化学平衡移动方向不同 | B. | 甲、乙平衡是NO2的体积分数相同 | ||
| C. | 甲、乙平衡是N2O4的体积分数甲<乙 | D. | 甲、乙升温时,υ(逆)增大、υ(正)减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 224 mL | B. | 168 mL | C. | 112 mL | D. | 448 mL |
查看答案和解析>>
科目: 来源: 题型:解答题
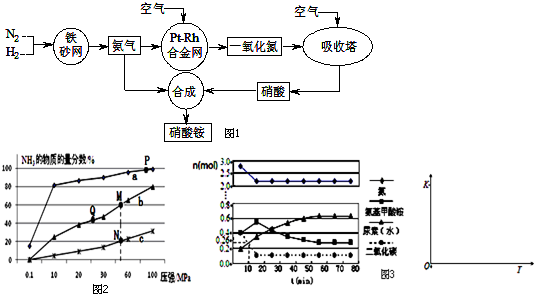
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
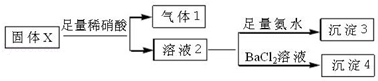
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3和KAlO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度平衡向正反应方向移动 | |
| B. | 该反应在任何温度下均能自发进行 | |
| C. | 向容器中充入少量He,平衡向正反应方向移动 | |
| D. | 该反应的△S<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com