
科目: 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 橄榄石中铁为+2价 | |
| C. | 月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 | |
| D. | 斜长石的氧化物形式可表示为:K2O•Al2O3•3SiO2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
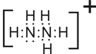
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在一定条件下,反应CO(g)+2H2(g)?CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 | |
| B. | 常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol/L | |
| C. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| D. | 已知某温度下:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L K2CrO4溶液,则先产生Ag2CrO4沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②2H2(g)+CO2(g)?H2O+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水电离出的c(OH):③>①>② | |
| B. | 溶液的pH:②>③>① | |
| C. | ①和②等体积混合后的溶液:c(Na+)═c(H2C03)+c(HC03)+c(C032-) | |
| D. | ①和③等体积混合后的溶液:c(Na+)>c(HC03-)>c(C032-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com