
科目: 来源: 题型:解答题
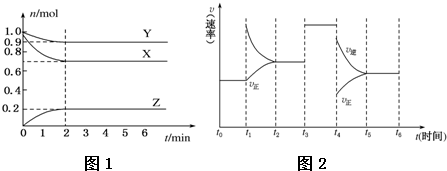
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
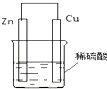 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C>D>B>A | B. | D>B>A>C | C. | A>D>C>B | D. | B>A>C>D |
查看答案和解析>>
科目: 来源: 题型:解答题
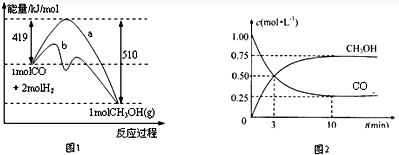
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | X | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 14% | B. | 16% | C. | 11% | D. | 20% |
查看答案和解析>>
科目: 来源: 题型:解答题
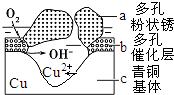 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
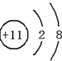 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com