
科目: 来源: 题型:解答题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/(mg•L-1) | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
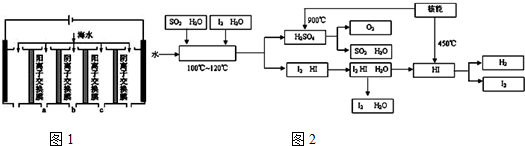
查看答案和解析>>
科目: 来源: 题型:解答题
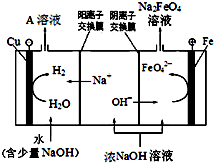 铁及其化合物在生产生活中具有重要的作用.
铁及其化合物在生产生活中具有重要的作用.查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
.
查看答案和解析>>
科目: 来源: 题型:解答题
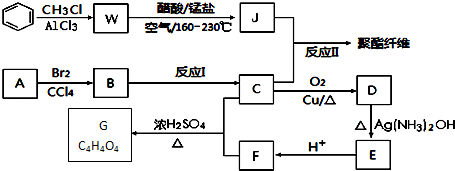
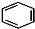 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$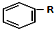 +HCl(-R为烃基)
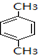
+HCl(-R为烃基) $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$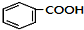
 .
. .
.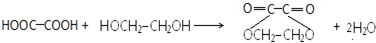 .
.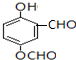 (写出一种即可);
(写出一种即可);查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 现象或客观事实 | 解 释 |
| A | 浸泡KMnO4溶液的硅土延长果实的成熟 | 利用乙烯可以发生加成反应 |
| B | 钾原子比钠原子更易失去电子 | 钾的核电荷数比钠的多 |
| C | SO2能使氯水褪色 | SO2具有还原性 |
| D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子序数:D>C>B>A | B. | 氢化物的稳定性:H2C>HD | ||
| C. | 离子半径:C2->D->B+>A2+ | D. | 氧化性:A2+>B+,还原性:C2-<D- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 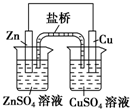 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 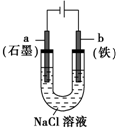 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 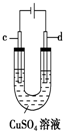 用装置精炼铜时,c极为粗铜 | |
| D. | 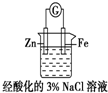 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④⑧ | B. | ①②③④⑤ | C. | ②③④⑤⑧ | D. | ④⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com