
科目: 来源: 题型:选择题
| 氧化物 | 酸 | 碱 | 盐 | |
| A | CuO | HCl | NH3•H2O | Na2SO4 |
| B | CO2 | CH3COOH | 火碱 | Cu(OH)2 |
| C | H2O | HBr | 纯碱 | BaSO3 |
| D | MnO2 | HClO | 生石灰 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化碳是温室气体,但不是大气污染物 | |
| B. | 农村常用明矾净水,是利用了胶体的性质 | |
| C. | 食品添加剂对人体无害,可大量食用 | |
| D. | 氯化钠是常用的防腐剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
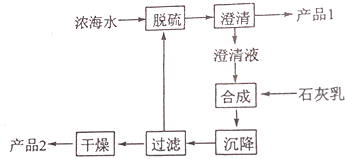
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
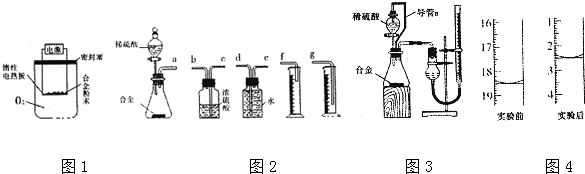
查看答案和解析>>
科目: 来源: 题型:解答题
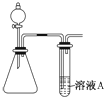 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| D. | Na2O2晶体中既含有离子键又含有共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 欲配制1.00 L 1.00mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0g金属钠 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子晶体中共价键越强,熔沸点越高 | |
| B. | 只含共价键的物质,一定是共价化合物 | |
| C. | HF的分子间作用力大于HCl,故HF比HCl更稳定 | |
| D. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 |
查看答案和解析>>
科目: 来源: 题型:选择题
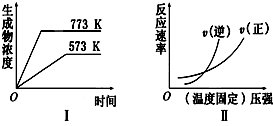
| A. | 2SO3(g)?2SO2(g)+O2(g)△H>0 | B. | N2(g)+3H2(g)?2NH3(g)△H<0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的浓度相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| C. | 达到平衡时,Ⅰ途径的反应速率υ1等于Ⅱ途径的反应速率υ2 | |
| D. | 达到平衡时,Ⅰ途径混合气体的密度等于Ⅱ途径混合气体的密度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com