
科目: 来源: 题型:解答题
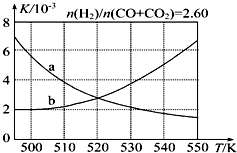 甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
查看答案和解析>>
科目: 来源: 题型:解答题
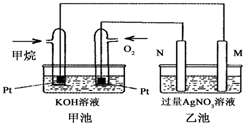 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
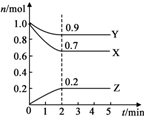 某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
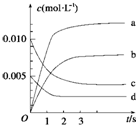 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目: 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol•L-1•min-1 | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
 在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应体系;某温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二.下列分析正确的是( )| A. | 0~4 min时,A的平均反应速率为0.1 mol/(L•min) | |
| B. | 该反应是一个吸热反应 | |
| C. | 平衡后升高温度,K值增大 | |
| D. | 该反应的平衡常数表达式为:K=$\frac{c(C)}{{c}^{2}(A)c(B)}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应I2(g)+H2(g)?2H I(g) 达平衡后,压缩体积体系颜色变深 | |
| B. | H2O2中加入二氧化锰,生成氧气的速率加快 | |
| C. | 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若反应中加入的是18O2,达到平衡后SO2中不可能含有18O | |
| B. | 平衡时,SO3的浓度可能为0.2mol/L | |
| C. | 当不再生成SO3时反应达到平衡 | |
| D. | 温度不变,改变SO2和O2的加入量,达到平衡时$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})(C{O}_{2})}$不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠常温下与氧气反应生成Na2O,升高温度生成 Na2O的速率加快 | |
| B. | 常温下,铜与稀硝酸反应生成NO,增大硝酸的浓度,生成NO的速率加快 | |
| C. | 锌与稀硫酸制备氢气,加入少量的硫酸铜溶液,生成H2的速率加快 | |
| D. | 对密闭容器中发生的反应2NO2?2NO+O2 缩小体积,增大压强,V(正)减小,V(逆)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com