
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
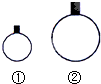
| A. | 常温常压下,相同物质的量的物质,其体积一定相等 | |
| B. | 常温常压下,用等质量的H2、CH4两种气体分别吹出如图所示的两个气球,其中①号气球内气体一定为CH4 | |
| C. | 任何条件下,等物质的量的氮气和一氧化碳所含的分子数、原子数不一定相等 | |
| D. | 1mol金属镁与其他物质发生化学反应,金属镁失去的电子数一定是2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纳米铜是一种新型单质 | |
| B. | 纳米铜颗粒比普通铜更难与氧气发生反应 | |
| C. | 纳米铜与普通铜所含铜原子的种类相同 | |
| D. | 纳米铜无需密封保存 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在标准状况下,1L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏伽德罗常数NA可近似表示为$\frac{m+n}{22.4}$mol-1 | |
| B. | 标准状况下,32g O3和O2的混合气体中,含有氧原子数一定为2NA | |
| C. | 等体积、等浓度的磷酸溶液和盐酸溶液,其溶液中含有的氢元素质量之比一定为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比一定为2:6 |
查看答案和解析>>
科目: 来源: 题型:解答题
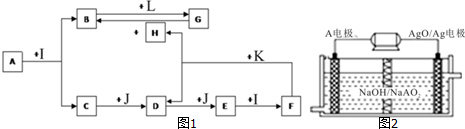
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com