
科目: 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)═c(Na+)>c(H+)=c(OH-) | |
| D. | 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)═c(Na+)+c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | V一定等于0.2 | |
| B. | V大于或等于0.2,也有可能小于0.2 | |
| C. | 混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 混合溶液中离子浓度可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3溶液的碱性增强 | |
| B. | 阳极反应:CO32--2e-+H2O═CO2↑+2OH- | |
| C. | 溶液中CO32-+H2O?HCO3-+OH-平衡不移动 | |
| D. | 向溶液中加入一定量HCOOH的能复原 |
查看答案和解析>>
科目: 来源: 题型:选择题
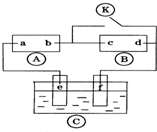 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3 的水溶液:NaHCO3═Na++H++CO32- | |
| B. | 熔融状态的NaHSO4:NaHSO4═Na++HSO4- | |
| C. | HF的水溶液:HF═H++F- | |
| D. | H2S 的水溶液:H2S?2H++S2- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 灯光变暗;二者电离常数相同 | B. | 灯光变暗;电离常数醋酸大于氨水 | ||
| C. | 灯光变亮;电离常数醋酸小于氨水 | D. | 灯光变亮;电离常数醋酸等于氨水 |
查看答案和解析>>
科目: 来源: 题型:解答题
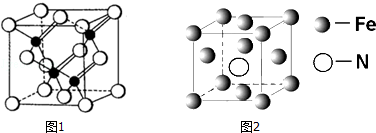
查看答案和解析>>
科目: 来源: 题型:解答题
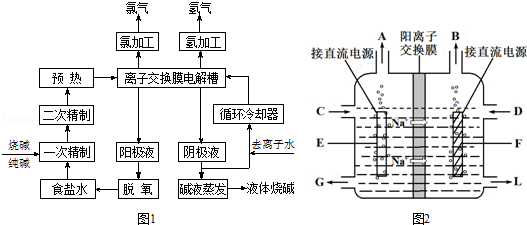
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol NH4+含有的电子数为11NA | |
| B. | NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂 | |
| C. | 0.1 L 3 mol•L-1的NH4NO3溶液中氮原子数等于0.6NA | |
| D. | 硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键 |
查看答案和解析>>
科目: 来源: 题型:解答题
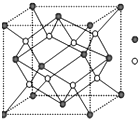 A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com