
科目: 来源: 题型:解答题
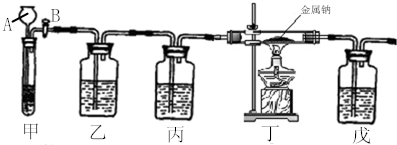
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 9.02g | B. | 8.26g | C. | 8.61g | D. | 7.04g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,一定不能自发进行反应 | |
| B. | 已知:CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H,则△H表示CH4的燃烧热 | |
| C. | 恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)?2C(g),充分反应后测得放出的热量为Q kJ,则该反应的△H=-Q kJ/mol | |
| D. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子里含有双键的有机物一定是烯烃 | |
| B. | 分子里含有苯环和羟基的化合物一定属于酚类 | |
| C. | 醛类的通式是CnH2nO(n≥1) | |
| D. | 相对分子质量为46的烃的含氧衍生物不一定是乙醇 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分别将它们配制成溶液,再加入澄清石灰水 | |
| B. | 分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸 | |
| C. | 分别将它们配制成溶液,再加入CaCl2溶液 | |
| D. | 分别加热,再用石灰水检验是否有CO2产生 |
查看答案和解析>>
科目: 来源: 题型:填空题
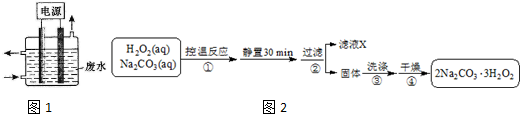
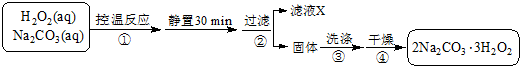
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜片插A硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 盐酸滴入澄清石灰水:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 将金属Na加入冷水中:2Na+2H2O═2Na+++2OH-+H2↑ | |
| D. | 向含0.5molFeBr2的溶液中通入0.5molC12:2Fe2++C12═2Fe3++2C1- |
查看答案和解析>>
科目: 来源: 题型:选择题
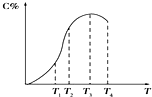 有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )
有可逆反应A+B?2C,以相同的投料方式开始反应.在不同温度下经过相同一段时间,测得混合物中C的百分含量与温度关系如图所示,下述中正确的是( )| A. | 温度为T2时该反应达到平衡 | |
| B. | 该反应为吸热反应 | |
| C. | 温度为T4时,v正<v逆 | |
| D. | 温度为 T3 T4时,该反应都处于平衡状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com