
科目: 来源:0116 期末题 题型:计算题
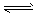 3C(g),起始时按5:2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%,求:
3C(g),起始时按5:2的体积比把A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使之反应,达平衡时混合气体中C的体积分数为60%,求:查看答案和解析>>
科目: 来源:0118 期末题 题型:单选题
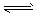 2XY2
2XY2 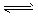 X2Y
X2Y 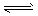 2X3Y
2X3Y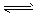 2XY3
2XY3 查看答案和解析>>
科目: 来源:0101 期中题 题型:单选题
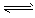 C(气)+ D(气) 5 min后达到平衡。已知各物质的平衡浓度的关系为:[A]a [B] = [C][D],若在温度不变情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为
C(气)+ D(气) 5 min后达到平衡。已知各物质的平衡浓度的关系为:[A]a [B] = [C][D],若在温度不变情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为查看答案和解析>>
科目: 来源:0101 期中题 题型:单选题
 2SO3(g)平衡体系中: n (SO2) =2.0 mol/L , n(O2) = 0.8 mol/L, n (SO3)=2.4 mol/L ,则 SO2 的起始浓度的范围为
2SO3(g)平衡体系中: n (SO2) =2.0 mol/L , n(O2) = 0.8 mol/L, n (SO3)=2.4 mol/L ,则 SO2 的起始浓度的范围为 查看答案和解析>>
科目: 来源:0101 期中题 题型:填空题
 xC(g),2 min时反应达到平衡状态(温度不变),剩余0.8 mol B,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g),2 min时反应达到平衡状态(温度不变),剩余0.8 mol B,并测得C的浓度为0.4mol/L,请填写下列空白:查看答案和解析>>
科目: 来源:0101 期中题 题型:填空题
 2C(g)+D(g)
2C(g)+D(g) 查看答案和解析>>
科目: 来源:0101 期中题 题型:填空题
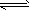 PCl5(g),平衡时容器内压强为开始时的6/7。计算并回答
PCl5(g),平衡时容器内压强为开始时的6/7。计算并回答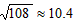 )
) 查看答案和解析>>
科目: 来源:北京期中题 题型:单选题
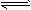 Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);△H=+QkJ·mol-1 (Q>0)。某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 查看答案和解析>>
科目: 来源:北京期中题 题型:填空题
 2O(g) ΔH=a kJ·mol-1;NO2(g)
2O(g) ΔH=a kJ·mol-1;NO2(g)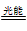 NO(g)+O (g) ΔH=b kJ·mol-1;
NO(g)+O (g) ΔH=b kJ·mol-1;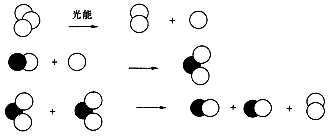
 2NO(g)+O2(g) 在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在
2NO(g)+O2(g) 在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在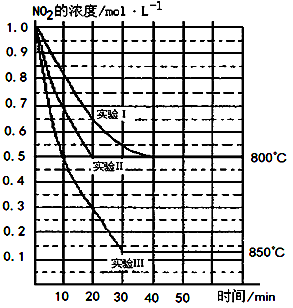
查看答案和解析>>
科目: 来源:0102 期中题 题型:填空题
 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com