
科目: 来源: 题型:解答题
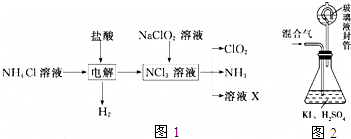
查看答案和解析>>
科目: 来源: 题型:解答题
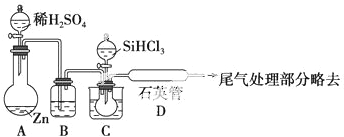
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al-Al2O3-Al(OH)3-NaAlO2 | B. | S-SO3-H2SO4-MgSO4 | ||
| C. | Mg-MgCl2-Mg(OH)2-MgO | D. | Si-SiO2-H2SiO3-Na2 SiO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电池总反应的离子方程式为:Mg+H2O2+2H+═Mg2++2H2O | |
| B. | 负极的电极反应为:H2O2+2H++2e-═2H2O | |
| C. | 工作时,正极周围海水的pH减小 | |
| D. | 电池工作时,溶液中的H+向负极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 阴极:2H++2e-═H2↑阳极:4OH--4e-═2H2O+O2↑ | |
| B. | 阴极:2H++2e-═H2↑阳极:2Cl--2e-═Cl2↑ | |
| C. | 阴极:Cu2++2e-═Cu阳极:4OH--4e-═2H2O+O2↑ | |
| D. | 阴极:Cu2++2e-═Cu阳极:2Cl--=2e-═Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com