
科目: 来源: 题型:选择题
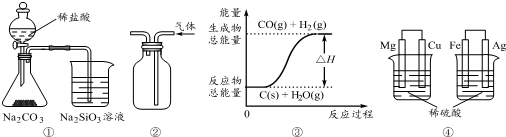
| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集NO2气体 | |
| C. | 图③表示可逆反应C(s)+H2O(g)?CO(g)+H2(g)的△H小于0 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在复盐NH4Fe(SO4)2溶液中加入过量的Ba(OH)2溶液:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| B. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| C. | 在燃煤时加入适量石灰石粉末,可减少SO2的排放:CaCO3+SO2═CaSO3+CO2 | |
| D. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I-+H2O2═I2+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
 下列有关如图所示装置的叙述中错误的是( )
下列有关如图所示装置的叙述中错误的是( )| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 药皂中加入少量苯酚,可以起到杀菌消毒的作用 | |
| C. | 石油是混合物,其分馏产品汽油为纯净物 | |
| D. | 金属铝需经过特别处理才具有抗腐蚀能力 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 弱电解质 | H2CO3 | NH3•H2O |
| Ka1 | 4.30×10-7 | 1.77×10-5 |
| Ka2 | 5.61×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-) | |
| B. | 浓度均为0.1 mol/L的 ①NH4Cl ②NH4HSO4③NH4HCO3三种溶液,其中c(NH4+):③>①>② | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 0.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化硫具有还原性,可用二氧化硫水溶液吸收溴蒸气 | |
| B. | 氢氟酸具有强酸性,可用氢氟酸蚀刻玻璃 | |
| C. | 氨气具有氧化性,可用浓氨水检验氯气管道是否泄漏 | |
| D. | SiO2的导电能力强,可用于制造通讯光缆 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com