
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
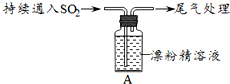 | i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1的CH3COOH | B. | 0.1 mol•L-1的NaHSO4 | ||
| C. | 0.1 mol•L-1的NaHCO3 | D. | 0.05 mol•L-1的H2SO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | W与X形成的化合物中只含离子键 | |
| B. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | X、Y、Z、W的原子半径依次减小 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、NO3-、OH-、Cl- | B. | Cu2+、SO42-、H+、Na+ | ||
| C. | H+、Ba2+、Mg2+、NO3- | D. | NH4+、MnO4-、H+、K+ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| B. | 将小烧杯中25mL蒸馏水加至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热,可以制取Fe(OH)3胶体 | |
| C. | 溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸 | |
| D. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现凝聚,再继续逐滴加到过量时,沉淀也不会消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com